Uno de los principales usos del litio es en la síntesis de compuestos organolíticos, RLi. Tienen gran importancia y utilidad en la industria y en la investigación química. Su reactividad se asemeja a la de los reactivos de Grignard, pero generalmente son más reactivos.
Síntesis
El mejor método general para la síntesis de RLi implica la reacción de un cloruro de alquilo o arilo con metal de litio en benceno o en un hidrocarburo alifático (por ejemplo, hexano), .
Si bien es posible utilizar éter dietílico (Et2 O), el disolvente ataca lentamente el compuesto de alquil-litio resultante, .
También pueden utilizarse el intercambio metal-hidrógeno, , el intercambio metal-halógeno y el intercambio metal-metal, .
Todos los compuestos de organolitio se producen como soluciones y, por tanto, se utilizan en los protocolos sintéticos por volumen de solución. Por lo tanto, es importante conocer la concentración exacta de RLi en la solución. El método más sencillo para cuantificar la cantidad de organolitio consiste en hacer reaccionar un volumen conocido con agua, y después valorar (con ácido) la base resultante que se forma.
Sin embargo, aunque la concentración de muestras recién preparadas de reactivos de organolitio puede medirse teóricamente de este modo, las muestras reales siempre contienen cierta cantidad de LiOH u otras bases. Una valoración simple resulta inevitablemente en una sobreestimación del reactivo de organolitio. Para superar este problema, se utiliza el método de doble valoración.
Método de doble valoración de Gilman
La adición cuidadosa de un volumen conocido de una solución de reactivo de organolitio (entre 0,5 y 1,5 ml) a un exceso de agua produce una solución de LiOH que puede valorarse con una solución estandarizada de ácido clorhídrico, utilizando fenolftaleína como indicador. La presencia de cualquier LiOH en la solución original de organolitio se incorporará a esta valoración y, por tanto, el resultado será una medida del contenido total de base en la solución, es decir, .
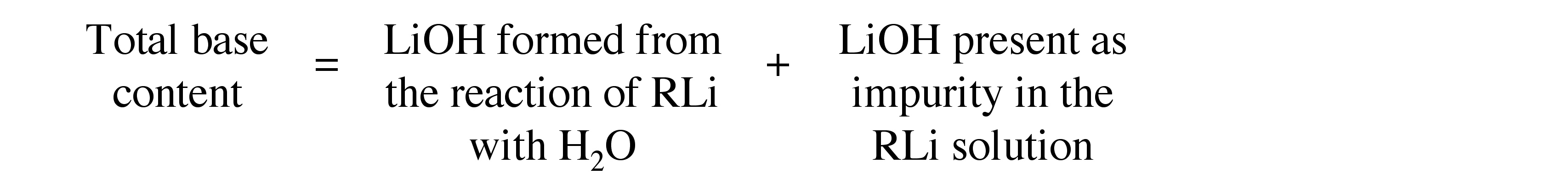
Para determinar la cantidad de LiOH presente como impureza en la solución de organolitio es necesario hacer reaccionar el RLi sin la formación de base y, a continuación, valorar la solución resultante. Para ello, se hace reaccionar lentamente una alícuota (la misma cantidad que la utilizada anteriormente) del organolitio con 1,2-dibromoetano (BrCH2 CH2 Br) disuelto en éter dietílico seco (Et2 O). Tras 5 minutos de agitación, se diluye la solución con un exceso de agua y se valora con una solución estandarizada de ácido clorhídrico, utilizando de nuevo fenolftaleína como indicador. La diferencia de las dos valoraciones da la concentración exacta del organolitio.
Se añadió una alícuota den BuLi en hexanos (0,50 mL) a agua desgasificada (20 mL). Después de que haya cesado cualquier reacción visible, se añaden unas gotas de una solución de fenolftaleína en agua/metanol que dan lugar a un color rosa indicativo de un pH básico. La mezcla resultante se valora con ácido clorhídrico normalizado ( = 0,1034 N) hasta la completa desaparición del color rosa (7,90 mL).
Se añade una segunda alícuota den BuLi en hexanos (0,50 mL) a 1,2-dibromoetano (0,20 mL, Et2 O). Tras 5 min de agitación, la mezcla se diluyó con agua (20 mL) y tras añadir el indicador de fenolftaleína se tituló (con agitación vigorosa debido a la naturaleza bifásica del sistema) con ácido clorhídrico normalizado (= 0.1034 N) hasta la completa desaparición del color rosa (0,25 mL).
La concentración de nBuLi se calcula como sigue: